讨论热点问题,鼓励儿童药研发,推动儿童用药发展
讨论热点问题,鼓励儿童药研发,推动儿童用药发展
远大九和参加药审中心组织的儿童药研发热点问题专家研讨会
为促进儿童药品研发,交流儿童用药研发中的遇到的热点问题,2021年9月24日(周五)下午2:30-5:00,中国医药创新促进会(以下简称:药促会)特邀我单位儿童药研发负责人聂红梅参加由药审中心组织关于“儿童用药研发热点问题”的线上专家研讨会。

鉴于疫情的影响,本次会议以线上线下相结合的方式举行,参会人员包括药审中心主任孔繁圃及负责审评工作的杨志敏、耿莹等数位药审工作人员、12位儿童药临床和研发专家教授以及10家国内外药企单位代表参与本次研讨会。
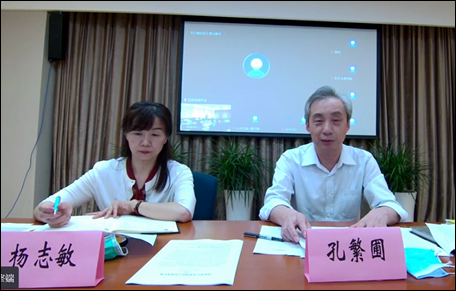
会议由药审中心化药临床一部部长杨志敏主持,首先介绍与会的各位专家领导,并对其参会表示诚挚的欢迎和感谢。
随后,孔繁圃主任对本次研讨会致欢迎词,首先对参会的各位科学家和企业家表示慰问。另外针对当前儿童药领域的现状进行简述,希望儿童医院的专家、企业和审评中心能够在这次专家会上充分的提出意见建议,产、学、研多方努力合作推动儿童药的研发、审评和发展。最后对各位专家领导的参会表示感谢。
在孔主任对儿童审评工作提出期望的基础上,国家儿童医学中心-北京儿童医院的倪院长对国家药审中心对儿童医学中心儿童药研发工作的大力支持和高度评价表示感谢。倪院长首先对儿童医学中心正进行2项儿童药重大专项课题进展情况进行汇报。另外,儿童医学中心也积极参与药审中心对于指导原则的制定工作,也牵头制定了“鼓励研发和申报儿童用药品的清单”。最后,倪院长表示,针对儿童药现状希望国家药品审评中心、医学中心和参会的各个参会企业,大家携手并进,满足儿童和家长的需求,共同做好儿童药的研发和发展。

针对两位领导的期望和总结,杨部长也表示药审中心儿童药工作组会根据今天与会的专家、领导的指示要求,踏实做好的儿童药工作。根据会议安排,随后进行与境外和境内的企业代表进行研讨。
首先,由境外企业辉瑞公司事务执行总监王海辉女士对境内外儿童用药相关法规进行梳理,建议国内儿童药相关部门规章和政策法规的制定可参考境外的模式,以鼓励,强制和优惠等方式加快儿童药的发展。


随后赛诺菲中国注册事务负责人邓婷女士对儿童用药临床要求的初步考虑进行介绍,主要包括现阶段儿童药物临床研究的挑战和建议,希望能够秉持科学、灵活、可行的原则。

最后一位境外企业代表为诺华注册部高蓉,针对当前儿童用药开发的政策建议和相关诉求进行总结,希望能够建立适用中国国情的激励政策和措施,如数据保护、特殊通道、多方合作的RWD儿童数据库平台和数据分享,以助推儿童用药创新的研发和上市。

接下来,由境内企业代表进行观点阐述。依次由北海康城注册负责人张苒、赛生医药武连宗、江苏恒瑞湖胡宏成分别进行主题为“对儿童用药研发过程中遇到的相关问题”、“境外上市的儿童用药注册进口我国相关问题”和“儿童用药临床研究相关问题”的介绍。



在企业观点阐述的基础上,药审中心化药临床一部耿莹对儿童用药专项工作小组对上一阶段工作进行汇报。在汇报中,耿部长针对当前中国儿童药研发现状,介绍了国家药审中心的采取的措施和成果,包括统一组织协调、深入一线调研、落实优先政策、完善研评标准、加强宣传培训等多举并措,随后也对下一阶段的工作计划进行阐述,同时希望广泛听取儿童临床专家、药物研发主题企业的声音和建议,以助推儿童用药研发创新。


最后,由顾学范教授、姜玉武教授、吴润晖主任、童笑梅主任等儿童药临床专家针对儿童药说明书规范、儿童罕见病用药缺口、儿童药品价格和相关政策等方面依次展开介绍;随后由倪邵青主任、王伊宁主任、崔一民教授、胡蓓主任、赵维教授、陈平雁教授等各位儿童药研发机构的专家针对儿童药的政策及审批流程、说明书内容调整、相关儿童药数据的质量、标准和数据库平台的建设等提出相关建议,并希望CDE从监管部门的角度多多组织沟通交流,在医生与企业之间进行知识谱普及,增强儿童药数据的科学和积累,合理设计选择儿童药研发的方式方法。
研讨会最后,杨志敏部长表示后期根据会上各位专家的建议意见,以及企业反馈的问题统一汇总后反馈。另外CDE也会针对《儿童用药(化学药品)药学开发指导原则》进行细致全面的解读培训,普及儿童药研发知识。